Гальванический элемент с максимальным эдс. Гальванические элементы. эдс
Из двух электродов может быть составлена электрохимическая цепь - гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Перенос заряда через границу раздела фаз (электрический ток) в такой системе осуществляется за счет электрохимической реакции, протекающей самопроизвольно. Электрод, на котором происходит электровосстановление, называется катодом, а электрод, на котором происходит электроокисление, называется анодом.
Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока.
Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, всегда должна заканчиваться одинаковыми по своему химическому составу металлами. Обычно это достигается простым подключением к металлам М 1 и М 2 медных проводов. Включение между двумя металлическими проводниками третьего металлического проводника, согласно закону Вольта, не изменяет разности потенциалов на концах цепи.
Электрохимическая цепь является равновесной при условии, что электрохимическое равновесие наблюдается на каждой фазовой границе, а разность потенциалов на концах цепи Е скомпенсирована разностью потенциалов от внешнего источника тока.
При схематической записи электрохимической цепи:
1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов;
2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя пунктирными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика).
В правильно разомкнутой цепи на концах условной записи элемента записывается один и тот же по природе металл. Для простоты часто в записи цепи его опускают.
Cогласно правилу записи электродной реакции, окисленная форма вещества и электроны записываются слева. , является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то – в обратном направлении.
Учитывая, что на катоде происходим электровосстановление, а на аноде – электроокисление, то в гальваническом элементе (при протекании самопроизвольных процессов) катод будет более электроположительным электродом, а анод более электроотрицательным. Если же элемент подключить к внешнему источнику тока и вызвать вынужденные электрохимические процессы (электролиз), то катодом будет более электроотрицательным электродом, а анод – более электроположительным. Во избежание путаницы термины катод и анод чаще употребляют при рассмотрении электролиза, а при рассмотрении гальванических элементов белее употребляют термины «плюс» и «минус» для обозначения катода и анода, соответственно.
Рассмотрим в качестве примера три случая.
1. Оба электрода имеют общий раствор:
Pt, H 2 (г) | HCl(aq) | AgCl | Ag
(1) AgCl + e Ag + Cl – (aq);
(2) 2H + (aq) + 2 e H 2 (г).
Суммарная реакция, протекающая в элементе
AgCl + 0.5H 2 (г) Ag + HCl(aq).
Если ЭДС этого элемента положительна, то суммарная реакция будет протекать в прямом направлении, правый электрод будет более положительным – плюсом (катодом), а левый электрод – более отрицательным – минусом (анодом).
2. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен);
Cd | Cd(NO 3) 2 (aq) ¦ NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e – Ag + Cl – (aq);
(2) Cd 2+ (aq) + 2 e Cd.
AgCl + 1/2Cd Ag + 1/2Cd 2+ (aq) + Cl – (aq).
3. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен).
Pt | H 2 (г) | HCl(aq) || NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e Ag + Cl – (aq);
(2) 2H + (aq) + 2 e – H 2 (г).
Суммарная реакция, формально протекающая в элементе
AgCl + 1/2H 2 (г) Ag + H + (aq) + Cl – (aq).
Предельное значение разности электрических потенциалов при токе через элемент, стремящемся к нулю, называется электродвижущей силой (ЭДС) и обозначается E.
ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент (рис.4).
Разность потенциалов на концах этой цепи складывается из трех гальвани-потенциалов:
![]() . (3.32)
. (3.32)
В общем виде в формировании ЭДС гальванического элемента участвуют не только скачки потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов – так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов – диффузионный потенциал.
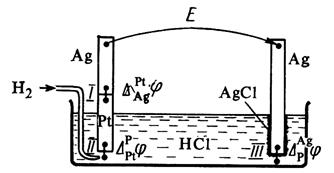
Рис. 4. Гальванический элемент, составленный из водородного
и хлоридсеребряного электродов.
Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (KCl, KNO 3).
Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения гальвани-потенциалов на границе раздела фаз в гальваническом элементе, значение Эдс гальванического элемента вычисляют как разность двух условных электродных потенциалов:
E = E п – E л, (3.33)
где E п– потенциал правого электрода, E л – потенциал левого.
Химические цепи
Гальванические элементы первого типа – химические цепи представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции.
В основе работы всякого электрохимического элемента лежат самопроизвольные окислительно-восстановительные реакции, протекающие раздельно: на более отрицательном электроде (аноде) - окисление, на более положительном (катоде) - восстановление.
Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Например, элемент Даниэля - Якоби составлен из двух электродов первого рода цинкового и медного. Последовательность соединения их изображают схемой:
Cu | Zn | ZnSO 4 (aq) ¦ CuSO 4 (aq) | Cu.
(1) Cu 2+ (aq) + 2 e – Cu;
(2) Zn 2+ (aq) + 2 e – Zn.
Суммарная реакция, протекающая в элементе
Zn + Cu 2+ (aq) Cu + Zn 2+ (aq).
ЭДС этого элемента
где ![]() .
.
Различают химические цепи с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относятся рассмотренный выше элемент Даниэля - Якоби.
Химические цепи с одним электролитом могут быть двух видов.
В цепях первого вида один электрод обратим относительно катиона, другой - относительно аниона. Например, элемент
Cd | CdCl 2 (aq) | AgCl | Ag
Он используется для определения среднего коэффициента активности электролита CdCl 2 . Рассчитаем ЭДС этого элемента.
где – средняя активность раствора CdCl 2 .
В гальванических элементах второго вида (с одним электролитом) оба электрода обратимы относительно одного из ионов. Примером может служить элемент
Hg | Hg 2 Cl 2 | KCl (aq) | Cl 2 (г) | Pt
Выражение для ЭДС этого элемента равно:
Если создать условия, при которых , то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
Примеры решения задач
Пример 1. Укажите знаки электродов и их тип, напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения процессов, протекающих в гальваническом элементе, схема которого:
Ni½NiSO 4 aq║ CoSO 4 aq½Co.
Вычислите ЭДС этого элемента, если а = 0,001 М, а = 1 М. Стандартные потенциалы электродов соответственно равны: = – 0,25 В; = – 0,28 В. Будет ли такой элемент работать самопроизвольно?
1. Так как стандартный потенциал электрода более положительный, чем у электрода , знаки у электродов такие:
(+) Ni½NiSO 4 aq║ CoSO 4 aq½Co (–).
Это электроды первого рода.
2. На электроде, имеющем более положительный потенциал (), происходит отдача электронов, то есть процесс окисления. Этот электрод называется анодом.
На электроде, имеющем более отрицательный потенциал (), происходит принятие электронов, то есть процесс восстановления. Этот электрод называется катодом.
Процессы, протекающие на электродах в гальваническом элементе:
_______________________________
Молекулярное уравнение: .
3. ЭДС элемента равна:
Е = Е + – Е- = – .
= + = – 0,28 + (0,059/2)lg1= – 0,28 В.
= + = – 0,25 + (0,059/2)lg0,001= – 0,34 В.
Е = – 0,28 – (– 0,34)= 0,06 В.
Так как ЭДС элемента положительная величина, то элемент работает самопроизвольно, так как .
Пример 2. М ожет ли самопроизвольно протекать реакция
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное и молекулярное уравнения. Определите ЭДС этого элемента при активности ионов в растворе, равных 1.
1. Составим гальванический элемент из двух электродов первого рода и . Согласно литературным данным = +0,22 В, а = – 0,40 В, поэтому схема гальванического элемента имеет вид:
Cd½ CdCl 2 (aq) || BiCl 2 (aq) Bi.
2. В гальваническом элементе на отрицательном электроде () протекает реакция окисления кадмия, а на положительном электроде () процесс восстановления иона висмута:
Ионно-молекулярное уравнение: .
Молекулярное уравнение: .
3. Так как активности ионов равны единицы, то электродные потенциалы будут равны стандартным электродным потенциалам. ЭДС элемента равна:
Е = – = +0,22 – (-0,40) = + 0,62 В > 0.
D r G = – zFЕ. Следовательно, D r G > 0 и рассматриваемая реакция
может протекать самопроизвольно.
Пример 3. Вычислить при 298 К ЭДС следующего элемента:
Zn ½ZnCl 2 aq ║ СdCl 2 aq ½Cd
C¢ =0,005 М С²=2 М
Стандартные потенциалы электродов Cd 2+ ½Cd и Zn 2+ ½Zn соответственно равны (– 0,402) и (– 0,763) В. Средние коэффициенты активности CdCl 2 и ZnCl 2 в растворах указанных концентраций равны 0,044 и 0,789. Можно ли за счет изменения концентрации ионов кадмия и цинка в растворах изменить направление тока в элементе?
Решение.Имеется электрохимический элемент, составленный из двух разных электродов первого рода. Сравнивая значения стандартных электродных потенциалов этих электродов, видим, что цинковый электрод в этой цепи электрод отрицательный (Е 0 = – 0,763 В), а кадмиевый – положительный (Е 0 = – 0,402 В).
На электродах протекают реакции:
(–) Zn = Zn 2+ +2 ,
(+) Cd 2+ +2 =Cd.
Суммарная реакция, протекающая при работе электрохимического элемента:
Zn + Cd 2+ = Zn 2+ + Cd.
Значения потенциалов каждого электрода равны:
![]() ;
;
![]() .
.
Значение ЭДС элемента равно:
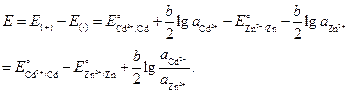
Подставим численные значения, учитывая, что активности ионов равны средней активности э соответствующих электролитов
где ![]() .
.
Для изменения направления тока в элементе, нужно, чтобы Е (–) стало больше Е (+) , т. е. чтобы Е стало отрицательным. Вычислим вначале, при каком отношении активностей ионов кадмия и цинка в растворе потенциалы электродов станут равными. В этом случае ЭДС примет значение, равное нулю.
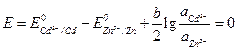 .
.
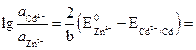
![]() .
.
Следовательно:
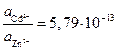 или .
или .
Результат расчета показывает, что изменением концентраций не может быть достигнуто даже равенство потенциалов, поскольку активность ионов цинка должна быть более чем в 10 12 раз больше активности ионов кадмия в растворе. Такие условия практически невозможно реализовать.
Пример 4. Разбавленный раствор FеС1 3 в 0,5 М НС1 (f ± HCl = +0,757) взбалтывается с ртутью (при 298 К), при этом протекает реакция
Fe 3+ + Hg + Cl - = Fe 2+ + 1/2 Hg 2 Cl 2
Определите отношение активностей / после установления равновесия в данной реакции, если стандартные потенциалы электродов Cl – /Hg 2 Cl 2 , Hg и
Fe 3+ , Fe 2+ /Pt относительно стандартного водородного электрода равны 0,268 и 0,771 В.
Решение. Составим электрохимический элемент, в котором бы протекала требуемая по условию реакция. Выберем каломельный и окислительно‑восстановительный железный электроды. По числовым значениям стандартных электродных потенциалов делаем вывод, что отрицательным будет каломельный электрод, а положительным – железный окислительно‑восстановительный. Запишем цепь:
(–) Hg, Hg 2 CI 2 | Cl – || Fe 3+ , Fe 2+ | Pt (+)
Электродные реакции, проотекающие в этом электрохимическом элементе
(–) Hg + Cl - = 1/2 Hg 2 Cl 2 + е -
(+) Fe 3+ + е - = Fe 2+
и суммарную реакцию, протекающую при работе составленного нами электрохимического элемента,
Hg + Fe 3+ + Cl - = Fe 2+ + ½ Hg 2 Cl 2 .
Сравнивая эту реакцию с реакцией, указанной по условию задачи и протекающей в колбе при взбалтывании FеС1з в НС1 с ртутью, делаем вывод, что реакции идентичны.
Запишем выражения для электродных потенциалов и ЭДС элемента:
![]()
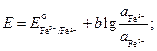
 .
.
По условию задачи требуется найти отношение активностей ионов железа после установления равновесия. Учтем, что электрохимический элемент работает до наступления равновесия, при этом ЭДС становится равной нулю:
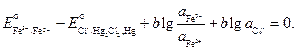
Выразим отсюда отношения активностей ионов железа:

Учитывая, что активность хлорид-ионов равна средней активности хлороводорода
где для HCl. Отсюда
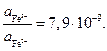
Вопросы для самоконтроля
1. Дайте определение термина стандартный электродный потенциал и объясните причину возникновения разности потенциалов между каким-либо металлом и раствором одной из его солей.
2. В химическом источнике тока
Pt½Fe +2 , Fe +3 ║ Ag + ½ Ag
протекает реакция:
Fe +2 (раств) + Ag + (раств) = Fe +3 (раств) + Ag (тв) .
Какое влияние (увеличение, уменьшение или отсутствие эффекта) должны оказать на напряжение источника тока следующие изменения:
а) увеличение концентрации Fe +3 (раств) ;
б) одновременное увеличение концентрации Fe +3 (раств) и Fe +2 (раств) в одинаковое число раз;
в) добавление твердого серебра;
г) добавление некоторого количества NaCl в раствор, где имеются ионы серебра.
3. Как определить направление самопроизвольного химического превращения при протекании процессов в электрохимическом элементе? Дайте обоснованный ответ, в каком направлении будет протекать самопроизвольно реакция:
4.Объясните, какой смысл имеют разделяющие знаки (½и║) в схематической записи химического источника тока:
Zn ½ZnSO 4 aq ║ CuSO 4 aq ½Cu
Укажите, где в этой схеме анод, а где катод? Объясните смысл терминов анод и катод и укажите на схеме направление потока электронов во внешней цепи.
5. Что должно произойти при введении ионов (в виде солей) в раствор, в котором содержится избыток разбавленной серной кислоты? Для объяснения воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов электродов: = 0,76 В; =1,52 В.
Концентрационные цепи
Гальванические элементы второго типа – концентрационные цепи представляют собой элементы, составленные из электродов, на которых протекают одинаковые химические реакции, но концентрации реагирующих веществ на электродах различны. Электрическая энергия в концентрационных элементах вырабатывается за счет выравнивания концентраций веществ.
Различают концентрационные цепи без переноса и с переносом. Концентрационными цепями без переноса называются элементы:
а) с одинаковыми электродами, но с разными концентрациями электролитов при отсутствии непосредственного соприкосновения между растворами;
б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации, опущенными в один раствор электролита;
в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа (с одним раствором электролита).
Примером концентрационной цепи без переноса может служить амальгамная концентрационная цепь:
где a1 и a2 – активности кадмия в амальгаме.
На электродах этого концентрационного элемента протекают следующие электрохимические реакции:
Суммарная реакция в элементе - ![]() .
.
ЭДС этого элемента вырабатывается за счет выравнивания активности кадмия в амальгамах ():
Концентрационными цепями с переносом называются такие концентрационные элементы, в которых имеется непосредственная граница соприкосновения между растворами. На границе между растворами двух одинаковых электролитов разной концентрации, в результате разной подвижности катионов и анионов, возникает так называемый диффузионный потенциал
Например,
Cu | CuSO 4 ¦ CuSO 4 | Cu
где и - различные активности ионов меди на электродах, j D - диффузионный потенциал, возникающий на границе растворов.
Запишем потенциалы обоих электродов:
![]() . (3.38)
. (3.38)
Тогда ЭДС элемента будет
Как правило, различие в концентрациях веществ на разных электродах концентрационных элементов мало, поэтому диффузионный потенциал вносит существенный вклад в общую ЭДС. Существует несколько соотношений для расчета ЭДС гальванического элемента с учетом диффузионного потенциала.
1. Если электроды обратимы относительно катиона, то ЭДС гальванического элемента будет равна:
![]() , (3.40)
, (3.40)
где t – –число переноса анионов, n – общее число формульных частиц, составляющих данный электролит (общее число ионов, на которые распадается электролит), n + - число формульных частиц катионов(число катионов, на которые диссоциирует электролит), составляющих данный электролит.
Диффузионный потенциал рассчитывается в этом случае по соотношению: .
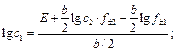
Откуда с 1 = 0,68 М.
Вопросы для самоконтроля
1. Сколько электродов может входить в состав концентрационного элемента?
2. Чем отличаются концентрационные элементы с переносом ионов от концентрационных элементов без переноса ионов?
3. Концентрационный элемент имеет вид:
K(Hg)|KCl(aq)|AgCl,Ag,AgCl|KCl(aq)|K(Hg)
Сколько гальванических элементов в его составе? Оцените знаки элементов, обеспечивающие самопроизвольную работу элемента. Как рассчитать ЭДС этого элемента?
4. Концентрационный элемент имеет вид:
Hg, HgO|KOH(aq)|KOHaq)|HgO,Hg.
К какому типу относится этот концентрационный элемент? Оцените знаки электродов, обеспечивающие самопроизвольную работу элемента. Как рассчитать ЭДС этого элемента?
5. Как связана ЭДС элемента с константами диссоциации электролитов CH 3 COOH и HCOOH?. К какому типу гальванических элементов относится данный элемент и почему?
H 2 ,Pt |CH 3 COOH(aq)|HCOOH(aq)| Pt, H 2 ,
7ОСНОВЫ ЭЛЕКТРОХИМИИ
7.1ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Рассмотрим реакцию:
Zn + CuSO 4 → ZnSO 4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn , Fe , Cu , Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции :
Zn - 2e → Zn 2+
Cu 2+ + 2e → Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 6.1 показана схема гальванического элемента , т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
Рисунок 6.1 - Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд А и соединяющая оба сосуда трубка В заполнены раствором ZnSO 4 , сосуд Б - раствором CuSO 4 . В первый из них опущена цинковая пластинка, во второй - медная. Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO 4 2- . Электрод , на котором происходит процесс восстановления (на рисунке 6.1 - медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере - цинковый) - анодомВ электротехнике принята противоположная система обозначений электродов: катодом называют отрицательный полюс источника тока, т.е. электрод, передающий электроны во внешнюю цепь (в данном случае цинковый). В учебном пособии электроды названы так, как это принято в электрохимии. .
В данном случае электродные процессы являются гетерогенными , т.к. окисленная и восстановленная формы находятся в разных фазах . В более общем виде гетерогенный электродный процесс можно записать в виде:
Me (ВФ, тв . фаза) - n e - Me n + (aq ) (ОФ, раствор)
На границе раздела фаз возникает двойной электрический слой , состоящий из катионов Me n + (в растворе) и электронов (в металле), что приводит к появлению потенциала E (Me n + /Me ). Его абсолютная величина определению не поддается, однако легко измеряется разность потенциалов катода и анода, которая называется электродвижущей силой (ЭДС) гальванического элемента Δ E =E к -E а . Если в таких устройствах условно считать потенциал какого-то электрода равным нулю, то измерением ЭДС можно получить относительные значения других электродных потенциалов, что важно для сравнительной количественной характеристики электродов.
Условно за нуль принят потенциал стандартного водородного электрода , который состоит из платиновой пластинки, покрытой платиновой чернью и частично погруженной в раствор кислоты с активной концентрацией ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом под давлением 1,013 · 10 5 Па (1 атмосфера), что приводит к образованию системы:
2 H + + 2eH 2
Для измерения электродных потенциалов металлов, например меди , составляют гальванический элемент, в котором вторым электродом служит стандартный водородный электрод. В основе работы составленного гальванического элемента лежит реакция
Cu 2+ + H 2 → 2H + + Cu
На схеме гальванического элемента границы раздела фаз показывают одной вертикальной чертой, а электроды отделяют друг от друга двумя вертикальными чертами. Анод на схеме указывают слева, а катод - справа:
А (-)Pt (H 2) | 2H + || Cu 2+ | Cu (+) К
Катодом в этом случае является медный электрод. ЭДС гальванического элемента, измеренная при концентрации (активности) ионов меди 1 моль/л,равна 0,34 В и может быть выражена как Δ E =E (Cu 2+ /Cu )-E (2H + /H 2). Так как E (2H + /H 2) принят за нуль, то E (Cu 2+ /Cu )= Δ E =0,34В при стандартных условиях. Если медь заменить цинком , то катодом будет водородный электрод . Тогда E (Zn 2+ /Zn )= - Δ E = -0,76В.
Электродные потенциалы металлов, измеренные по отношению к водородному электроду при стандартных условиях, т.е. активной концентрации ионов металла в растворе, равной 1 моль/л, и температуре 25 ° С (298 К), называют стандартными и обозначают Е ° . Так, Е ° (Cu 2+ /Cu )=0,34В, Е ° (Zn 2+ /Zn )= -0,76В. Ряд металлов, расположенных в порядке возрастания их стандартных электродных потенциалов, называется рядом напряжений . В основных чертах он имеет следующий вид:
K, Ca , Na , Mg , Al , Zn , Fe , Ni , Sn , Pb , H , Cu , Hg , Ag , Pt , Au
Ниже приведены основные следствия из ряда напряжений:
а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него.
б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее - не вытесняют.
Величина электродного потенциала зависит от концентрацииВ данном случае имеется в виду молярная концентрация (моль/л). ионов металла в растворе его соли , их заряда (n ) и температуры (Т ), что выражается уравнением Нернста :
![]() ;
;
здесь F - число Фарадея (F =96485 96500 Кл/моль).
При Т =298 К можно применять упрощенную форму уравнения Нернста :
![]()
Если разделить пространственно процессы окисления и восстановления, то окислительно-восстановительную реакцию можно использовать для получения электрической энергии.
Устройство в котором, химическая энергия превращается в электрическую, называется гальваническим элементом . Гальванический элемент образуется из двух металлов, погруженными в раствор электролитов. Если соединить эти металлы проводником первого рода (металлический провод), то будет образовываться электрический ток, появляющийся вследствие возникновения окислительно-восстановительного процесса. В гальваническом элементе анодом служит электрод, электродный потенциал которого в данном растворе более электроотрицательный. На аноде происходит окисление. Катодом служит электрод из менее активного металла. На катоде восстановляются положительные ионы металлов, ионы водорода или нейтральные молекулы. В гальваническом элементе анод обозначается знаком «минус», а катод – знаком «плюс». Гальванический элемент показан на рисунке.
Цинковая пластинка опущена в раствор сульфата цинка, медная - в раствор сульфата меди. Пластинки соединены проводом, растворы разделены пористой перегородкой, чтобы не происходило смешение растворов. Электроны по внешней цепи идут от анода к катоду, а по внутренней цепи анионы SO 4 2- перемещаются в растворе от меди к цинку, замыкая электрическую цепь гальванического элемента.
Гальванический элемент записывается в виде электрохимической схемы:
A(-) Zn | ZnSO 4 || CuSO 4 | Cu (+)K
Так как электродный потенциал цинка меньше электродного потенциала меди то цинк будет анодом, а медь – катодом. Цинковая пластинка окисляется, а на поверхности медной пластинки идёт восстановление меди из раствора.
Процессы, протекающие при работе гальванического элемента, следует записать:
A Zn – 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода:
ЭДС= е K - е A
Для медно-цинкового гальванического элемента в стандартных условиях:
ЭДС = 0,34-(-0,76)=1,1 В
Разность потенциалов образуется не только между разными, но и между одноименными металлами, прогруженными в растворы своих солей с разными концентрациями. Такой гальванический элемент называется концентрационным . Например, никелевый концентрационный гальванический элемент.
(-)Ni | NiSO 4 || NiSO 4 | Ni (+)
0,01моль 0,1моль
Запишем работу такого концентрационного гальванического элемента.
е Ni 2+ / Ni = е 0 + (0,058/n)lg(1*10 -2) = -0.25 + (0,058/2)(-2) = -0.308 В
е Ni 2+ / Ni = е 0 + (0,058/n)lg(1*10 -1) = -0.25 + (0,058/2)(-1) = -0.28 В
ЭДС = -0,28 – (-0,308) = 0,028 В
Процессы на электродах:
А: Ni 0 - 2е - = Ni 2+
К: Ni 2+ + 2е - = Ni 0
КОНТРОЛЬНЫЕ ЗАДАНИЯ
48. Вычислить ЭДС кадмиево – серебряного гальванического элемента, если концентрация ионов серебра в растворе равна 0,1 моль/л, а ионов кадмия 0,001 моль/л. Напишите уравнения реакций протекающих на электродах.
49. Составьте схемы двух гальванических элементов в одном из которых никель – катод, а в другом анод. Напишите уравнения реакций протекающих при работе этих элементов.
50. Рассчитайте ЭДС гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0,1М растворы их солей. Напишите уравнения реакций.
51. Рассчитайте ЭДС концентрационного никелевого гальванического элемента. Концентрация ионов металла в растворах равна 1 моль/л и 0,0001 моль/л. Написать процессы, протекающие на аноде и катоде.
52. Какие процессы происходят у электродов медного коцентрированного гальванического элемента, еслиу одного из электродов концентрация ионов металла равна 1 моль/л, а у другого 0,001 моль/л. в каком направлении движутся электроны во внешней цепи. Чему равна ЭДС?
53. Составьте схему гальванического элемента, состоящего из пластин Zn и Fe погруженных в растворы их солей. Напишите уравнения процессов, протекающих на ионы железа, чтобы ЭДС элемента стала равной нулю при концентрации ионов цинка 0,0001 моль/л.
54. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите уравнения реакций, протекающих на пластинах.
55. Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 1М раствор нитрата серебра и стандартного водородного электрода. Напишите урaвнения электродных процессов. Чему равна ЭДС элемента?
56. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов
а) Mg | Mg 2+ | | Pb 2+ | Pb
б) Pb | Pb 2+ | |Cu 2+ | Cu
в) Cu | Cu 2+ | | Ag 2+ | Ag
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев.
57. Составьте схему гальванического элемента в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO 3) 2 = Ni(NO 3) 2 + Pb .
Напишите электронные уравнения анодного и катодного процессов, вычислите ЭДС этого элемента при стандартных условиях.
58. ЭДС гальванического элемента, образованного медной пластинкой, погруженной в раствор ее соли с концентрацией ионов меди, равной 0,001 моль/л и хромом, погруженным в раствор его соли равна 1,05 В. определите концентрацию ионов хрома в растворе его соли. Составьте схему гальванического элемента и напишите электронные уравнения электродных процессов.
59. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенные в растворы своих солей с концентрацие ионов металлов, равной 1 моль/л. изменится ли ЭДС этого гальванического элемента, если концентрацию каждого из ионов уменьшить до 0,01 моль / л.
60. ЭДС гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1М раствор соли свинца равна 126мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода. Составьте схему гальванического элемента и напишите процессы, протекающие на электродах.
61. Какие процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора.
62. Какие процессы протекают на электродах при зарядке и разрядке кадмиево-никелевого аккумулятора.
63. Какие процессы протекают на электродах при зарядке и разрядке железно-никелевого аккумулятора.
64. Составьте схемы двух гальванических элементов в одном из которых хром был бы анодом, а в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах.
65. Составьте схему гальванического элемента, состоящего из алюминиевого электрода, погруженного в 1М раствор нитрата алюминия и стандартного водородного электрода. Напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента.
66. В каком направлении будут перемещаться электроны во внешней цепи алюминий – цинкового гальванического элемента. Концентрации ионов в растворах равны 0,1 моль/л. Составьте схему гальванического элемента, напишите уравнения процессов, протекающих на электродах, вычислите ЭДС.
67. В серебряно-цинковом элементе, применяемом для питания различной аппаратуры, протекает реакция
ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Во время электролиза положительно заряженные ионы перемещаются к катоду, который соединяется с отрицательным полюсом внешнего источника постоянного тока, а отрицательно заряженные ионы перемещаются к аноду, который соединяется с положительным полюсом источника постоянного тока. На поверхности катода идет процесс восстановления, на аноде – окисление.
Рассмотрим электролиз расплава хлорида натрия.
При погружении в расплав, состоящий из ионов Na + и Cl - , двух графитовых электродов, подключенных к источнику тока, в электролите начнется направленное движение ионов, и на электродах будут протекать окислительно-восстановительные процессы.
Схема электролиза расплава натрия:
NaCl = Na + + Cl -
Катод (-) (+) анод
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
Суммарное уравнение реакции:
2Na + + 2Cl - электролиз 2 Na + Cl 2
2NaCl электролиз 2Na + Cl 2
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду, и также могут участвовать в процессах на электродах.
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов. Чем больше величина электродного потенциала элемента, тем легче его восстановление.
Первыми на катоде восстанавливаются ионы тех металлов, потенциал которых самый положительный. Например, раствор с ионами Ag + и H + . Первым восстанавливается Ag:
Ag + + e - = Ag 0 e 0 = +0,8 B
Водород не восстанавливается, так как его потенциал меньше.
Потенциалы металлов и водорода зависят от их концентрации в электролите. Поэтому по значениям стандартного потенциала судить о восстановлении ионов Н + не всегда можно. В нейтральном расторе концентрация ионов водорода равна10 -7 моль/л. и по формуле Нернста:
Следовательно водород может выделяться из нейтральных растворов только при потенциале меньше –0,41В, а металлы на катоде будут выделяться лишь те, потенциал которых положительнее потенциала –0,41В.
На практике из водородных растворов выделяется немало металлов (Zn, Fe, Cr и др.), значение электродных потенциалов которых менее –0,41В.
Это объясняется перенапряжением водорода, т.е. на поверхности большинства металлов водород выделяется с затруднениями. Величина перенапряжения водорода зависит от свойств металла, плотности тока и температуры электролита. Перенапряжение – зто разница потенциалов между практическим потенциалом выделением водорода и теоретическим.
Пример .
Потенциал выделения цинка в нейтральном электролите –0.76В, водорода –0.41В. перенапряжение водорода на цинке около –0.72В. Таким образом, водород на цинке будет выделяться лишь при потенциале –0.41+(-0.72)=-1.13В. Если сравнить потенциал разряда цинка (-0.76 В) с потенциалом разряда водорода на цинке (-1.13В), ясно, что будет выделяться цинк. На деле так и есть, при электролизе нейтрального раствора соли цинка выделяется цинк и малое количество водорода.
При обобщенном процессе на катоде, в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1.18В (от Li до Mn). Восстанавливаются ионы водорода:
2 Н + + 2е - = Н 2 РН < 7
2 Н 2 О + 2е - = Н 2 + 2ОН - РН >= 7
2) ионы металлов, электродный потенциал которых от –1.18В до 0.00В (от Mn до Н) В этом случае восстанавливаются как ионы металлов, так и ионы водорода одновременно:
Me n+ + ne - = Me 0
2H + + 2e - = H 2 PH<7
2H 2 O + 2e - = H 2 + 2OH - PH>=7
3) ионы металлов, электродный потенциал которых больше 0.0В (от H до Au). В этом случае восстанавливаются только ионы металлов
Ме n+ + ne - = Me 0
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. На их поверхности окисляются анионы с более отрицательными потенциалами. Это ионы не содержащие кислорода, такие как J - , Br - , Cl - , S 2- и др. (исключение F -)
Если в растворе имеются ионы Cl - , Br - , то окисляться на инертном аноде будут ионы Br - .
2Br - - 2e - = Br 2
2H 2 0 - 4e - = O 2 +4H + (PH<=7)
4OH - 4e - = 2H 2 O + O 2 (PH>7)
Рассмотрим несколько случаев электролиза водных растворов.
Пример.
Схема электролиза водного раствора хлорида меди с инертным анодом CuCl 2 = Cu 2+ +2Cl -
H 2 O = H + = OH -
Катод(-) Cu 2+ H + (H 2 O) Cl - , OH - (H 2 O) (+)анод
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
У меди потенциал больше 0, поэтому на катоде восстанавливается металл, на аноде окисляется бескислородный кислотный остаток.
Пример.
Схема электролиза раствора сульфата калия с инертным анодом. K 2 SO 4 = 2K + + SO 4 2
H 2 O = H + + OH -
Катод(-) 2K + ,H + (H 2 O) SО 4 2- , OH(H 2 O) (+)анод
2H 2 O + 2e - = H 2 + 2OH - 2H 2 O – 4e - = O 2 + 4H +
K + + OH - = KOH 2H + + SO 4 2- = H 2 SO 4
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода и накопление ионов ОН -
У анода будет идти окисление молекул воды и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример .
Электролиз водного раствора сульфата никеля с активным анодом. Ni SO 4 = Ni 2+ = SO 4 2-
H 2 O H + + OH -
Катод(-) Ni 2+ , H + (H 2 O) SO 4 2- , OH - (H 2 O) (+)анод
Ni 2+ +2e - = Ni 0 Ni – 2e - = Ni 2+
e 0 Ni = -0.25B больше потенциала восстановления ионов водорода из воды(-0,41В), поэтому восстанавливается металл, а на аноде происходит окисление анода-металла, так как потенциал никеля намного меньше потенциала окисления воды (+1,23В).
Законы электролиза
Масса электролита, подверженная химическому превращению, а также массы веществ, выделившихся на электродах по законам Фарадея прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
 , где
, где
m -масса электролита, подвергшаяся электролизу или масса веществ, выделившаяся на электродах, г;
J -сила тока, А;
э-молярная масса эквивалентов вещества, г/моль;
F-число Фарадея – 96500 Кл;
t-время электролиза, с;
КОНТРОЛЬНЫЕ ЗАДАНИЯ
68. Составьте уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl 2 с инертными электродами.
69. Составьте схемы электролиза водных растворов серной кислоты, хлорида меди, нитрата свинца с платиновыми электродами.
70. Напишите уравнения электродных процессов, протекающих при электролизе водных растворов хлорида бария и хлорида железа (II) с угольными электродами.
71. Составьте схемы электролиза водного раствора хлорида цинка, если а) анод цинковый; б) анод угольный.
72. Какой объем водорода выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор серной кислоты.
73. При электролизе водного раствора SnCl 2 на аноде выделилось 4,48 л. хлора (условия нормальные). Какое вещество и в каком количестве выделилось на катоде.
74. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди. Напишите уравнения процессов на электродах.
75. Составьте схему процессов, происходящих на медных электродах при электролизе водного раствора нитрата калия.
76. Неочищенная медь содержит примеси серебра и цинка. Что происходит с этими примесями при электролитическом рафинировании меди. Напишите уравнения процессов на электродах.
77. Сколько времени потребуется для полного разложения 2 молей воды током силой 2А.
78. Через растворы поваренной соли и фосфата натрия пропустили в течение некоторого времени постоянный ток. Изменится ли от этого количество соли в том и в другом случае. Ответ мотивируйте, составив электронные уравнения процессов идущих на катоде и аноде.
79. При электролизе раствора сульфата меди (II) на аноде выделилось 0,168 л газа (нормальные условия) составьте электронные уравнения процессов и вычислите, какая масса меди выделится на катоде.
80. Составьте электронные уравнения процессов происходящих при электролизе раствора и расплава КОН.
81. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течении 2,5 часов если сила тока равна 6 А.
82. Сколько граммов серной кислоты образуется возле анода при электролизе раствора сульфата натрия, если на аноде выделится 1,12л кислорода (н.у.) вычислить массу вещества, выделившегося на катоде.
83. При электролизе раствора нитрата серебра на аноде выделилось 0,28 л кислорода. Сколько граммов серебра выделилось на катоде.
84. В воде растворены соли алюминия, цинка и меди с концентрацией катионов 1 моль/л. составьте электронные уравнения процессов на электродах и укажите последовательность реакций на катоде.
85. Какие продукты могут быть получены при электролизе раствора NaNO 3 , если анодное и катодное пространства:
а) разделены пористой перегородкой;
б) не разделены и раствор перемешивается.
86. Какие продукты будут выделяться на катоде и аноде в первую очередь при электролизе водных растворов с графитовыми электродами, если в электролите находится смесь сульфата меди (II) и хлорида калия.
87. В водный раствор нитрата серебра опущены медная и серебряная пластинки. К какому полюсу источника тока должна быть присоединена медная пластинка для покрытия ее серебром. Напишите схему процесса электролиза.
КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называется самопроизвольное разрушение металла под действием окружающей среды. Коррозия представляет собой окислительно-восстановительный гетерогенный процесс, происходящий на поверхности раздела фаз. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химической коррозией называется окисление металла, не сопровождающееся возникновением электрического тока в системе. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и с органическими жидкостями – неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока.
Металлы, применяемые в технике, содержат примеси других металлов, поэтому при соприкосновении с раствором электролита на их поверхности получается большое количество непрерывно действующих микрогальванических элементов. Более активный металл – анод окисляется с образованием катионов металла или нерастворимых продуктов, например, ржавчины. Освобождающиеся электроны перемещаются к катоду, на котором происходит восстановление окислителя. Растворенный кислород и ионы водорода – важнейшие окислители вызывающие коррозию, называют катодными деполяризаторами. Какой именно процесс восстановления будет протекать на катоде зависит от состава электролита.
Пример .
При контакте железа и меди находящихся в растворе хлороводородной кислоты образуется микрогальванический элемент:
A Fe| HCl | Cu K
e 0 Fe/Fe2+ = -0,44B
e 0 Cu/Cu2+ = +0,34B
Железо - более активный металл будет анодом, а медь – катодом. Реакции, протекающие на аноде и катоде, могут быть выражены:
1 A: Fe -2e = Fe 2+
1 K: 2H + + 2e = H 2
Суммирую анодные и катодные процессы, получим окислительно-восстановительную реакцию, самопроизвольное протекание которой обуславливает коррозию металла:
Fe + 2H + = Fe 2+ + H 2
Fe + 2HCl = FeCl 2 + H 2
Пример.
При коррозии в нейтральной среде, в отсутствие растворенного в воде кислорода происходит так же водородная деполяризация катода, как и в предыдущем примере.
Запишем схему гальванического элемента и уравнения реакций, протекающих в этом гальваническом элементе:
A Fe|H 2 O| Cu K
1 A: Fe – 2e = Fe 2+
1 K: 2H 2 O + 2e = H 2 + 2OH -
Fe + 2H 2 0 = Fe 2+ + H 2 + 2OH -
Или в молекулярном виде: Fe + 2H 2 O = Fe(OH) 2 + H 2
Пример .
При контакте железа с медью во влажном воздухе процессы образуется гальванический элемент
A Fe| H 2 O + O 2 | Cu K
И процесс коррозии выражается следующими уравнениями:
A: Fe – 2e = Fe 2+
K: O 2 + 2H 2 O + 4e = 4OH -
2Fe + O 2 + 2H 2 O = 2Fe(OH) 2
Под влиянием кислорода воздуха, гидроксид железа(2) окисляется дальше по уравнению
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
Как видно из примера, в этом случае происходит кислородная деполяризация катода.
Возможность протекания самопроизвольного окислительно-восстановительного процесса рассчитывается по ЭДС
ЭДС= е восстановителя – е окислителя
Если ЭДС процесса больше нуля, то процесс возможен.
Электрическая работа равна произведению напряжения (разности потенциалов) на количество прошедшего электричества. В изобарно-изотермических условиях (при постоянных температуре и давлении) максимальная электрическая работа гальванического элемента может быть получена при максимальной разности потенциалов электродов. Максимальная разность потенциалов ΔЕ, равная разности равновесных электродных потенциалов катода (Е к ) и анода (Е а ) элемента, называется ЭДС гальванического элемента
ΔЕ = Е к - Е а
Если электроды находятся в стандартных условиях, то
ΔЕ 0 = Е к 0 - Е а 0 ,
где ΔЕ 0 – стандартная ЭДС элемента,а Е к 0 и Е а 0 – стандартные электродные потенциалы катода и анода, соответственно.
Если на электроде испытывает превращение один моль вещества, то по закону Фарадея через систему протекает количество электричества, равное nF , где n – число молей эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества равна:
A
max.электр.
= nF ΔЕ (1)
ΔЕ (1)
В то же время максимальная полезная работа А max. ОВР , которую может совершать система при протекании реакции при постоянных температуре и давлении, равна энергии Гиббса реакции:
А max. ОВР = - ΔG Р (2)
Так как А max. ОВР = A max.электр. , то:
ΔЕ = - ΔG Р /nF. (3)
В стандартных условиях
ΔЕ 0 = - ΔG Р 0 /nF , (4)
где ΔЕ 0 и ΔG o - стандартные ЭДС и энергия Гиббса реакции.
Следовательно, при известных значениях энергии Гиббса реакции можно рассчитать ЭДС элемента, и наоборот. Уравнение (4.3) показывает связь между химической и электрической энергиями. Энергия Гиббса реакции зависит от активностей. Например, для реакции:
аA (г)
+ bB (г)
 cC (г)
+ dD (г)
cC (г)
+ dD (г)
 G
=
G
=
 G o
+ RT
G o
+ RT
 =
=
 G o
-
RT
G o
-
RT
 (5)
(5)
 G
=
G
=
 G o
+ RT
G o
+ RT
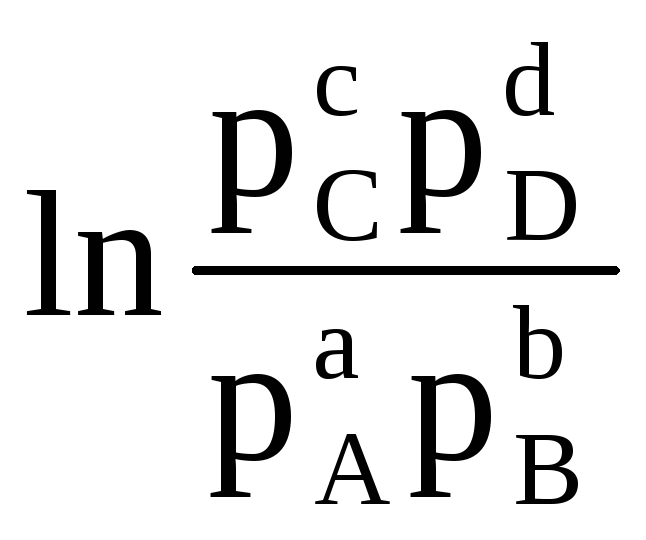 =
=
 G o
- RT
G o
- RT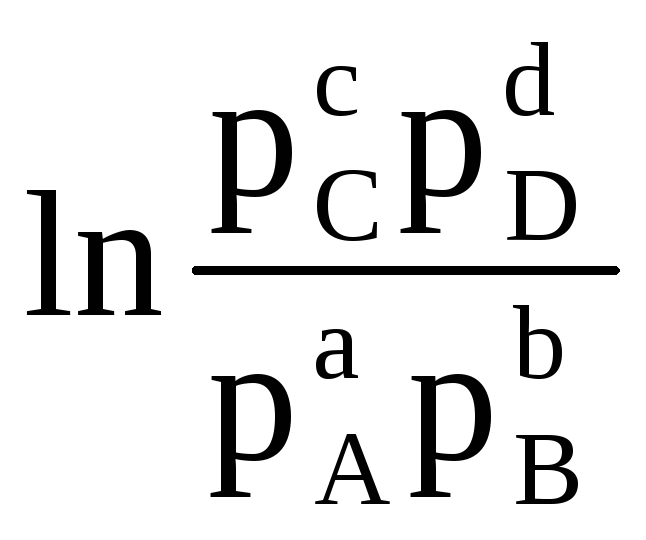 (6)
(6)
Подставляя уравнение (4.5) в уравнение (4.3), получаем:
ΔЕ
=
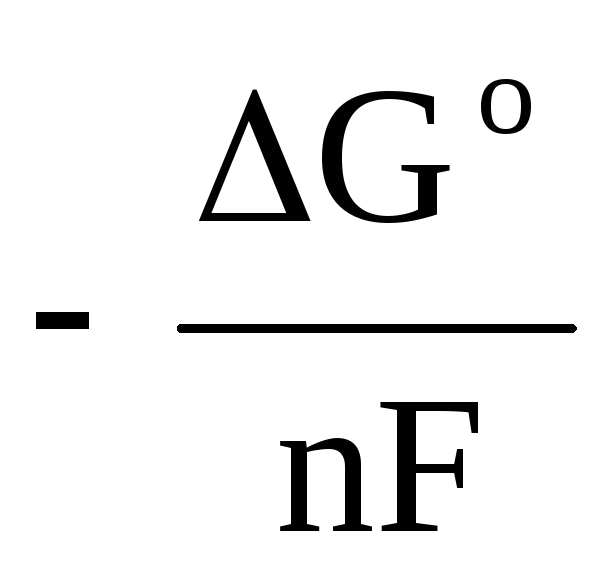 +
+
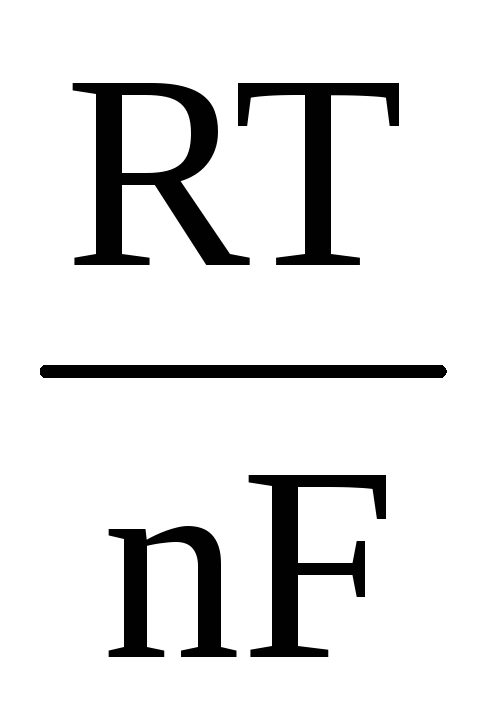
 (7)
(7)
(при стандартных условиях, т.е. при активностях всех участников реакции равных единице, ΔЕ = ΔЕ 0 ). Если в реакции участвуют газообразные вещества, то в уравнении (4.7) активности заменяют парциальными давлениями соответствующих веществ.
Таким образом, стандартной называется ЭДС элемента, если активности (или парциальные давления) исходных веществ и продуктов реакций равны единице. Величину стандартной ЭДС (ΔЕ 0 ) гальванического элемента можно вычислить по уравнению (4.4), если известна величина стандартной энергии Гиббса реакции. Последнюю легко рассчитать, зная энергию Гиббса образования продуктов реакции и исходных веществ.
В качестве примера запишем уравнение для расчета ЭДС элемента Даниэля – Якоби:
ΔЕ
= ΔЕ
0
+
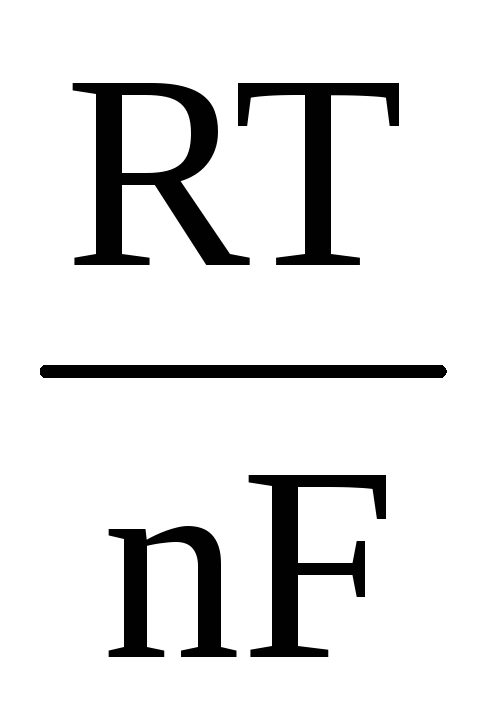
 (8)
(8)
Активности твердых Zn и Cu равны единице (реакции, протекающие на электродах, являются гетерогенными). Поэтому получаем:
ΔЕ
= ΔЕ
0
+
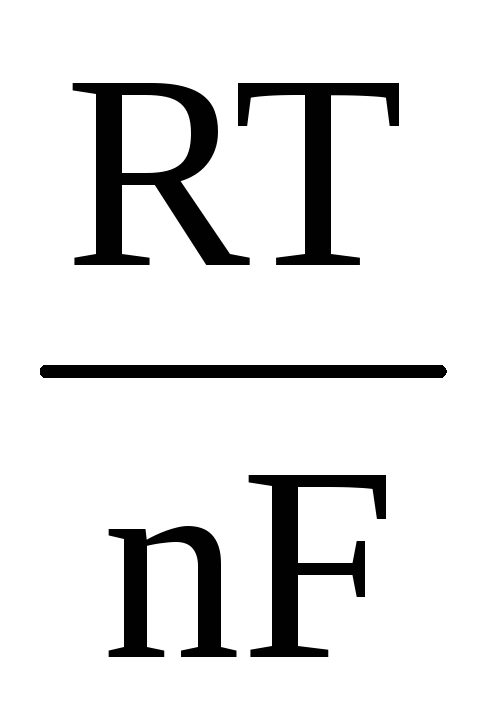
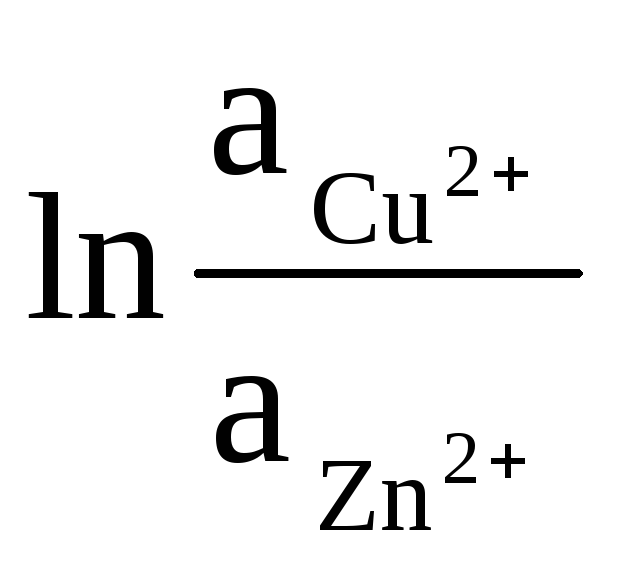 (9)
(9)
При
замене натурального логарифма на
десятичный и подстановке соответствующих
значений концентраций (а Ме
 ),
а также численных значений R, F
и
стандартной температуры 298К, уравнение
(4.9) приобретает еще более простой вид:
),
а также численных значений R, F
и
стандартной температуры 298К, уравнение
(4.9) приобретает еще более простой вид:
ΔЕ
= ΔЕ
0
+

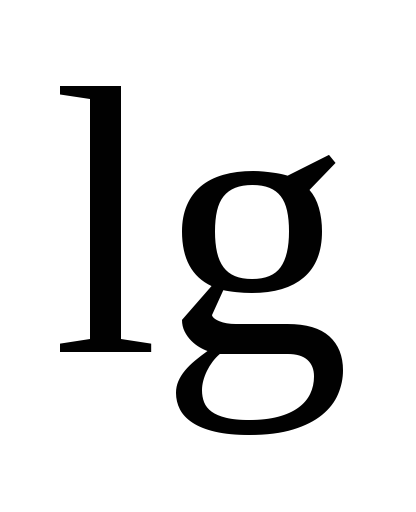
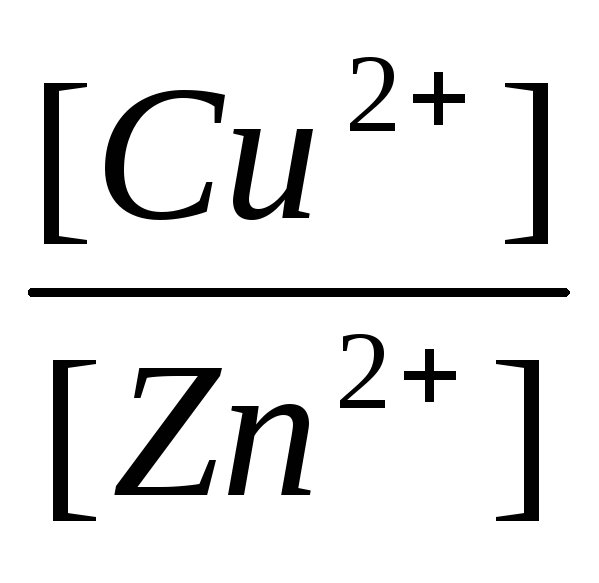 (10)
(10)
ΔЕ
= ΔЕ
0
Cu
+2 / Cu
-
ΔЕ
0
Zn +2 / Zn
+

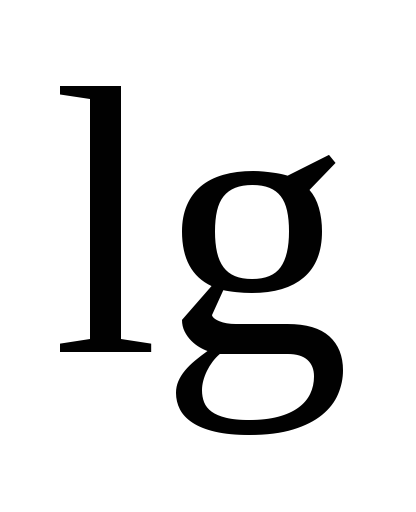
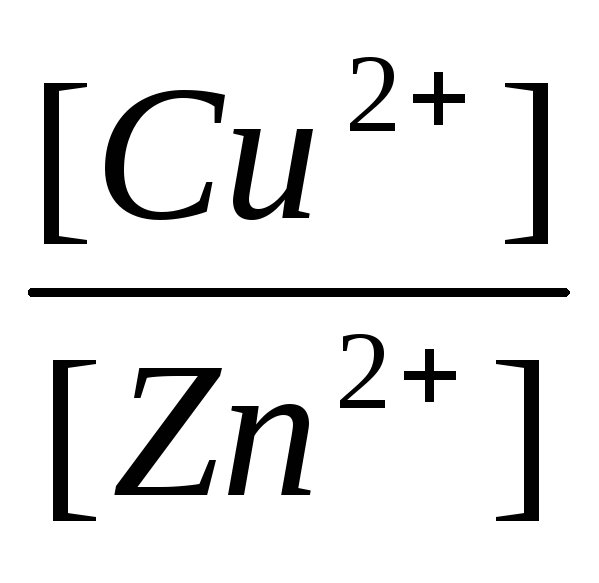 , (11)
, (11)
где n - число электронов, участвующих в процессе окисления-восстановления;
ΔЕ 0 Cu +2 / Cu и ΔЕ 0 Zn +2 / Zn - стандартные электродные потенциалы в вольтах (В);
ΔЕ 0 Cu +2 / Cu - ΔЕ 0 Zn +2 / Zn = ΔЕ 0 - стандартная ЭДС гальванического элемента;
И - концентрации, соответственно, ионов меди и цинка в растворах CuSO 4 и ZnSO 4 , в моль/л.
Измерение ЭДС гальванических элементов. Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента, т.е. U < ЭДС. Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока и другими эффектами. Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором ток, протекающий через элемент равен нулю. Для этого к элементу от внешнего источника тока подводят ЭДС с противоположным знаком. В измерительную цепь включается также гальванометр для регистрации тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно ЭДС гальванического элемента (момент компенсации ЭДС), ток в цепи равен нулю (стрелка гальванометра не отклоняется). Измеренное в этот момент вольтметром напряжение на клеммах гальванического элемента равно его ЭДС.
Cтраница 1
Электродвижущая сила гальванических элементов может быть подсчитана по уравнению изотермы реакции Вант-Гоффа. Таким способом легко выводится известное уравнение Нернста. В обратимом гальваническом элементе электрическая энергия получается за счет химической энергии. Приравняем эту величину к величине электрической энергии гальванического элемента.
Электродвижущая сила гальванического элемента зависит от химического состава электролита и электродов, а также от температуры элемента и давления в нем. Применим второй закон термодинамики к обратимому гальваническому элементу.
Электродвижущая сила гальванического элемента зависит от химических и физических свойств веществ, его составляющих, и не зависит ни от формы и размеров элемента, ни от его внутреннего устройства. Но внутреннее устройство и размеры отдельных частей элемента имеют большое влияние на его внутреннее сопротивление, так как оно зависит от расстояния между полюсами (при уменьшении этого расстояния внутреннее сопротивление элемента уменьшается), от размера погруженной в жидкость поверхности полюсов (при увеличении этой поверхности внутреннее сопротивление уменьшается), от химического состава жидкости элемента. Внутреннее сопротивление гальванических элементов не является постоянным и по мере работы элемента оно постепенно возрастает.
Электродвижущая сила гальванического элемента равна разности его электродных потенциалов: Е - Et - Ег, где Е - электродвижущая сила элемента, а Е1 и Еа - электродные потенциалы. Абсолютное значение электродного потенциала измерить нельзя, но можно определить электродвижущую силу гальванического элемента, составленного из двух электродов, причем потенциал одного из них условно принять равным нулю. Безусловно, при этом измеряют не абсолютную величину электродного потенциала, а его относительное значение. В качестве электрода с нулевым потенциалом принят нормальный водородный электрод (рис. 75), представляющий собой пластинку с нанесенной на нее мелко раздробленной платиной (платиновая чернь), погруженную в раствор серной кислоты.
Электродвижущая сила гальванического элемента, составленного из водородного и насыщенного каломельного электродов при 25 С, равна 0 760 в.
Электродвижущая сила гальванического элемента, составленного из насыщенного каломельного электрода и хингидронного электрода, заполненного исследуемым раствором при 18 С, равна 0 360 в.
Электродвижущая сила гальванического элемента из платины, серы, x - Ag2S и серебра оказалась равной нескольким тысячным вольта, вместо 0.2 в, которые должны были бы дать элемент, если бы он состоял из электролитов.
Электродвижущая сила гальванических элементов, применяемых в опытах Б и Г, равна алгебраической сумме отдельных потенциалов, возникающих на границах раздела следующих фаз: медь раствор, цинк раствор и уголь серная кислота.
Электродвижущая сила гальванического элемента Fe Fe2 OH - o2Pt составляет 1.235 В.
Электродвижущая сила составленного гальванического элемента во время титрования изменяется точно так же, как и потенциал индикаторного электрода.
Электродвижущую силу гальванических элементов измеряют с помощью так называемой компенсационной схемы. При этом ток в цепи исследуемого элемента равен нулю, что соответствует требованиям обратимости. Калиброванный пговод имеет одинаковое сечение по всей длине.
Измерение электродвижущей силы гальванических элементов часто используется для определения средних коэффициентов активности электролитов.
Величина электродвижущей силы гальванического элемента определяется только свободной стандартной энергией (А / 70) токообразующего химического процесса и не зависит от конструкции источника электрической энергии и размера электродов.
Величина электродвижущей силы гальванического элемента является мерой энергии окислительно-восстановительного процесса реакции замещения с металлами и измеряется разностью потенциалов между окислителем и восстановителем на полюсах гальванического элемента.
Вычислить электродвижущую силу гальванического элемента, образованного электродами Mg / Mg2 и Zn / Zna при CMg2b 0 1 моль / л, Czn r - 2 моль / л, и сравнить ее с электродвижущей силой гальванического элемента, образованного нормальными электродами тех же металлов.



